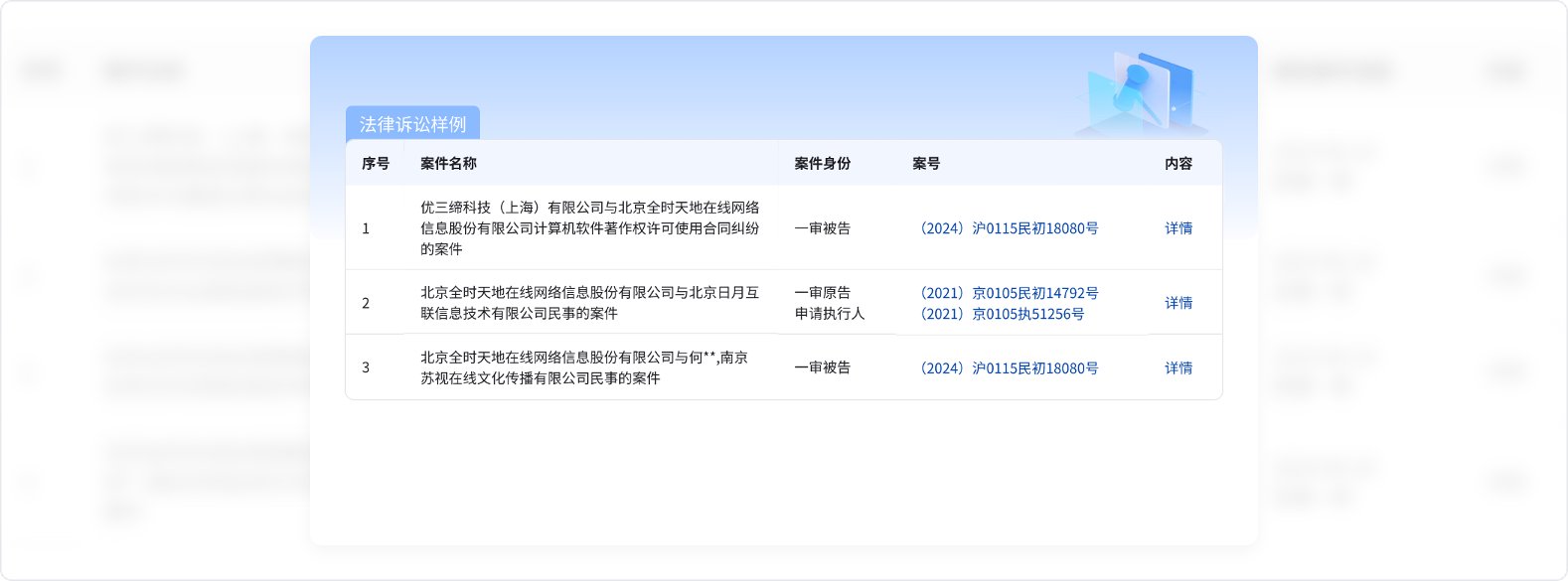
貼上您的名片
掃描二維碼進入虎易小程序投放名片,只需充值少量虎幣,即可張貼名片至
該產(chǎn)品“同類優(yōu)質(zhì)商家”欄目下,以相當?shù)偷某杀精@得大量曝光。
投放說明
>
名片曝光使用說明
步驟1:創(chuàng)建名片
微信掃描名片二維碼,進入虎易名片小程序,使用微信授權(quán)登錄并創(chuàng)建您的名片。
步驟2:投放名片
創(chuàng)建名片成功后,將投放名片至該產(chǎn)品“同類優(yōu)質(zhì)商家”欄目下,即開啟名片曝光服務,服務費用為:1虎幣/天。(虎幣充值比率:1虎幣=1.00人民幣)
關(guān)于曝光服務
名片曝光只限于使用免費模板的企業(yè)產(chǎn)品詳細頁下,因此當企業(yè)使用收費模板時,曝光服務將自動失效,并停止扣除服務費。
<
返回首頁
美國FDA QSR820工廠審核FDA cGMP質(zhì)量體系法規(guī)實戰(zhàn)培訓(北京站)
主辦方:深圳市龍德生物科技有限公司
課程大綱
1.FDA QSR 及510k概述
2.FDA審廠及Warning letter分析
3.QSIT介紹
4.管理控制
5.設計控制
6.糾正和預防CAPA,MDR及Recall
7.生產(chǎn)和過程控制
8.21CFR part803
9.21CFR part 806
10.21CFR Part 11
11.FDA審廠應對建議
12.應對FDA cGMP工廠審核五級模型
13.審核前準備重點及技巧
14.現(xiàn)場審核陪同要求及技巧:十六字方針
15.QSR工廠審核應對策略分析
討論溝通部分:
培訓時間及地點
時間:10月中上旬
地點:北京(具體時間將在培訓前10天另行通知)
培訓講師:Oscar
其他事項
1.本次培訓班為期3天。
2.培訓結(jié)束后,頒發(fā)QSR820內(nèi)審員結(jié)業(yè)證書。
3.培訓費2000元/人(含資料、文具、證書及培訓期間午餐費用),培訓期間食宿費用自理,會務組可協(xié)助安排。
4.報名辦法:請詳細填寫報名回執(zhí),傳真或發(fā)電子郵件至:train@hlongmed.com 、consultant@hlongmed.com 。
5. 報名截止:待定
聯(lián) 系 人:Annie/Anny
電 話:0755-86664693/13560790058
傳 真:0755-86664933
如需了解更多的信息,請登錄 http://www.hlongmed.com